| |
|
|
|
|
|
| |
En 2003, dans la revue Nature, une équipe japonaise annonce avoir découvert de la supraconductivité dans un oxyde contenant des plans triangulaires de cobalt mais seulement lorsqu'on y insère de l'eau ! C'est déjà dans cet oxyde qu'on avait observé quelques années auparavant d'étonnants pouvoirs thermoélectriques: ce matériau convertit la chaleur en électricité mieux qu'aucun autre. Un nouveau sujet de recherche est né... |
|
|
| |
Comment les atomes y sont organisés : |
|
|
| |
 |
 |
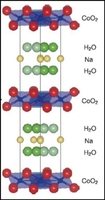
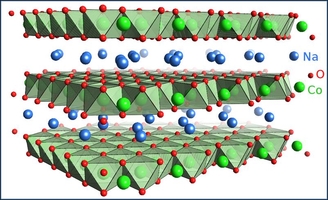
| Dans ces matériaux, des couches de sodium s'alternent avec des couches de cobalt entourés d'oxygènes, comme on le voit à gauche. A droite, vue de haut, la structure présente des plans triangulaires de cobalts.(en vert à gauche, |
|
|
|
| |
Supraconducteurs... quand on y insère de l'eau : |
|
|
| |
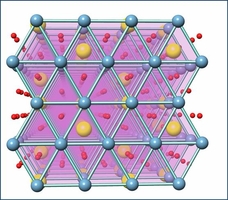
Ces matériaux ne sont pas supraconducteurs. Cependant, si on y insère des molécules d'eau entre les plans sodium et cobalt, alors ils deviennet supraconducteurs en dessous de 4 Kelvins, c'est à dire - 269°C. Certes, c'est froid et peu prometteur pour d'éventuelles applications. Mais pour les habitués de la supraconductivité, c'est très curieux: pourquoi des molécules d'eau, à priori totalement inertes du point de vue électrique, permettent-elles la supraconductivité ? Et quel mécanisme permet ici aux électrons de s'attirer ? A-t-on à faire à une supraconductivité classique comme dans l'Aluminium ou le Niobium, ou au contraire à un mécanisme exotique comme les supraconducteurs à haute Tc ? |
|
la structure de la molécule en présence d'eau |
|
|
|
| |
Ils transforment la chaleur en électricité : |
|
|
| |
Si on applique deux températures diférentes aux extrémités d'un métal ou d'un semi-conducteur, on peut provoquer l'apparition d'une minuscule tension électrique. Mais dans ces matériaux, cet effet est plus important que tout ce qu'on connaissait jusque là pour les métaux. Même si cela reste modeste (de l'ordre de 1 mVolt pour 10°C de différence), on pourrait esperer utiliser ces matériaux pour convertir la chaleur en énergie, comme par exemple la chaleur en sortie des pots d'échapement des voitures. L'origine de cette propriété n'est pas encore clairement comprise. Une possibilité serait que la présence des sodium fasse que les Cobalts ne soient pas tous identiques. Certains pourraient porter des petits aimants (spin), d'autres non. Et ces aimants pourraient alors être vers le haut ou le bas. De ce fait, pleins de configurations sont alors possibles, d'où une forte "entropie", une propriété qui represente justement toutes les configurations possibles dans un système. Cette entropie de spin permettrait alors d'expliquer ces forts pouvoirs thermoélectriques. |
|
|
| |
Ils font de très bonnes piles : |
|
|
| |
Les sodium peuvent se déplacer entre les plans de Cobalt et conduire le courant, ce qui permet d'utiliser ces matériaux comme piles. On appelle ces matériaux des conducteurs ioniques. Si on remplace le sodium par du lithium, celui-ci étant un atome plus léger et petit, il se déplace encore mieux, la pile est d'autant meilleure. Ces piles au Lithium et au Cobalt sont utilisées par exemple dans les baladeurs type Ipod. |
|
|
| |
Ils deviennent de vrais aimants précisément quand ils ne le devraient pas : |
|
|
| |
Chaque cobalt dans ces matériaux peut porter un petit aimant, "un spin". On s'attend à ce que lorsqu'on met peu de sodium, il y ait beaucoup de ces spins, et que peut-être ils s'alignent et forment un vrai aimant. C'est précisément l'inverse qui se produit : c'est quand on met beaucoup de sodium qu'on observe cet alignement à grande distance ! Au contraire, là où on l'attendrait, on ne voit plus trace de magnétisme, et les spins se font oublier. Pourquoi ? Nous cherchons... |
|
|
| |
Pour résumer leurs proriétés, un diagramme de phase : |
|
|
| |
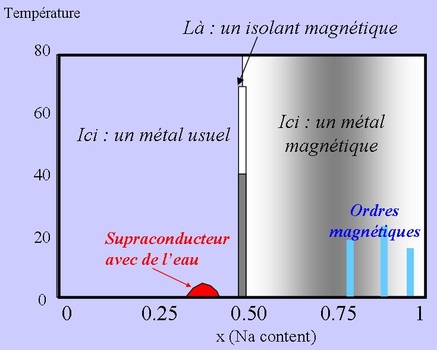 |
| En fonction du nombre de sodium entre les plans (axe horizontal), ils passent d'un bon métal, supraconducteur avec de l'eau, à un métal magnétique, ordonné parfois. On attendrait l'inverse... |
. |
|
|
| |
Ce que nous y mesurons nous même par RMN et muSR : |
|
|
| |
- Les propriétés magnétiques et les transitions de phase
- Les propriétés électroniques en fonction du dopage
- les valences des différents cobalts
- les caractéristiques de l'état supraconducteur et des états métalliques
- les corrélations électroniques
|
|
|
|
| |
|
|
|
|
|
| |
|
|
|
| |
|
|
|
|
|
| |
|
|
|
Henri Alloul, directeur de recherche
01 69 15 53 37 alloul@lps.u-psud.fr |
Philippe Mendels, professeur
01 69 15 53 39 mendels@lps.u-psud.fr |
Julien Bobroff, maître de conférence
01 69 15 53 36 bobroff@lps.u-psud.fr |
|
|
|
Guillaume Lang, en thèse
01 69 15 53 41 lang@lps.u-psud.fr |
Irek Moukhamedchine, visiteur
maître de conférences en Russie, à Kazan |
Yaroslav Dmitriev, en thèse
01 69 15 53 40 dmitriev@lps.u-psud.fr |
|
|
|
| |
|
|
|
|
|