La mucoviscidose se caractérise par des sécrétions visqueuses au niveau de plusieurs organes, principalement les poumons et le pancréas.
A l’heure actuelle, il existe des antibiotiques dirigés contre les inflammations pulmonaires (insuffisance respiratoire) car les personnes atteintes de mucoviscidose ont du mucus qui s’installe dans les poumons, ce qui favorise la prolifération de bactéries pathogènes (gros risque de complication). Il existe donc beaucoup de traitements pour prévenir les complications liées à cette maladie. De plus, la santé mentale des patients est aussi très importante c’est pourquoi ils sont la plupart du temps suivis par des psychologues (cf. Tableau récapitulatif des traitements préventifs).
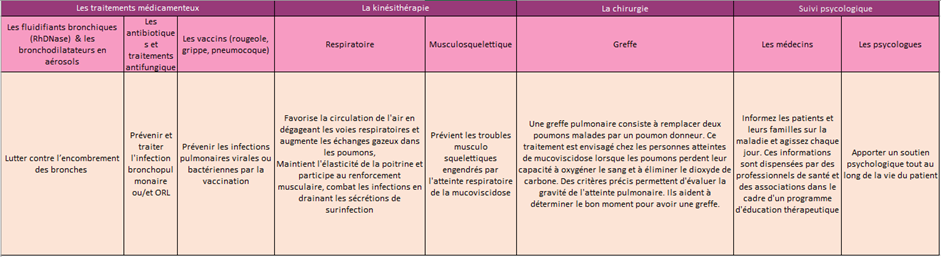
Les soins de la mucoviscidose sont multiples et quotidiens. Ils permettent de faciliter l’évacuation du mucus et la digestion. Leur suivi rigoureux est essentiel.
Pour lutter contre les troubles digestifs, les difficultés respiratoires, les carences en vitamine et les infections, les patients atteints de mucoviscidose doivent ingérer chaque jour une vingtaine de médicaments et se plier à une ou plusieurs séances d’aérosols et de kinésithérapie respiratoire.
Des extraits pancréatiques leur sont nécessaires pour mieux digérer les graisses, compenser la malabsorption des lipides dans l’intestin grêle et corriger les déficits nutritionnels. Auxquels s’ajoutent des suppléments vitaminiques A, D, E, K et bêta carotène, des oligo-éléments et du magnésium si carence. Parfois, s’ajoute un autre traitement en cas de diabète. En cas de problème au niveau des fonctions respiratoires, le médicament pulmozyme est souvent prescrit.
L’antibiothérapie permet de lutter contre les infections et les surinfections. Les antibiotiques sont administrés par voie orale, en aérosols ou en traitement intraveineux lors de cures de 15 jours minimum, suivant l’état de santé du patient. Les perfusions sont pratiquées à domicile ou à l’hôpital, à raison de deux ou trois perfusions par jour. Chaque séance dure entre une heure et demie et deux heures, en fonction du nombre d’antibiotiques prescrits. Durant ces périodes, les patients ne peuvent souvent pas se rendre à l’école ou assurer leur travail. Plus la maladie évolue, et plus la fréquence de ces cures augmente. En état critique, les patients sont perfusés en continu.Néanmoins, deux médicaments révolutionnent la vie des patients, ces médicaments sont Kaftrio & Symkevi. Ces deux médicaments visent à réparer la protéine CFTR, produit du gène muté, par une combinaison de correcteurs associés à un activateur de cette protéine. Il est donc possible d’améliorer la vie des patients grâce à ces dispositions, mais malheureusement, il n’existe aucun traitement, pour lutter contre le réel problème que sont : les mutations à codon STOP.
Concernant la prise en charge financière de la maladie, il a été récemment annoncé que ces deux médicaments vont désormais être officiellement remboursés par la Sécurité Sociale en France.
Ces traitements pourront être utilisés pour les patients âgés de 12 ans et plus et être pris en charge à 100 % par l’Assurance maladie.
Le coût annuel moyen des montants remboursés par l’assurance maladie est de 21 500 euros par patient, sachant que le coût moyen annuel des traitements en France est entre 15000 et 25000 euros. La part la plus élevée est consacrée aux médicaments avec un peu plus de 8 000 euros, puis à l’hospitalisation (7 300 euros). Les dispositifs médicaux dont le coût s’établit autour de 2 300 euros concernent surtout les appareils générateurs d’aérosols, l’oxygénothérapie, le matériel de perfusion et certains nutriments. La prise en charge de l’assurance maladie atteint en moyenne 2 200 euros pour la kinésithérapie et 900 euros pour les soins infirmiers.
Pour la prise en charge globale du patient, notamment psychologique, le patient nécessite d’être suivi par un psychologue ainsi que ses proches.
En effet, le moral du patient prenant une part importante dans son rétablissement, il est important d’être suivi. C’est pourquoi dès l’enfance, le patient a accès à des prises en charge à l’école grâce à des aides en parallèle des études.
Les recherches en cours
Nous savons qu’environ 10% des maladies humaines sont liées à l’apparition d’une mutation non-sens (PTC). Ce type de mutation provoque une terminaison prématurée de la traduction, conduisant à la synthèse d’une protéine tronquée ou à la dégradation de l’ARN et donc à l’absence de protéine.
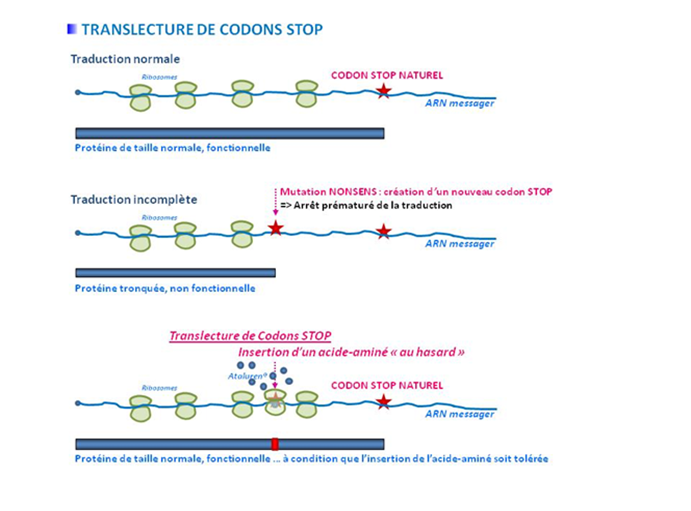
Les recherches en cours pour restituer la protéine tronquée sont basées sur le mécanisme de translecture.
On peut définir la translecture comme étant un processus traductionnel permettant le passage d’un codon stop afin de permettre la continuation de la traduction par le ribosome.
Comme à ce jour aucun traitement n’est disponible pour les patients atteints d’une maladie génétique causée par une mutation non-sens, l’identification de correcteurs efficaces de mutations non-sens est un enjeu majeur de la santé publique.
Les antibiotiques
Depuis une dizaine d’années, une stratégie thérapeutique utilisant la translecture est en cours de développement. Elle consiste à re-synthétiser une protéine complète en utilisant des molécules favorisant l’incorporation d’un ARNt au niveau de ce codon stop prématuré. Actuellement, les molécules les plus utilisées sont les antibiotiques de la famille des aminoglycosides (gentamicine, amikacine) qui se fixent au niveau du centre de décodage du ribosome.
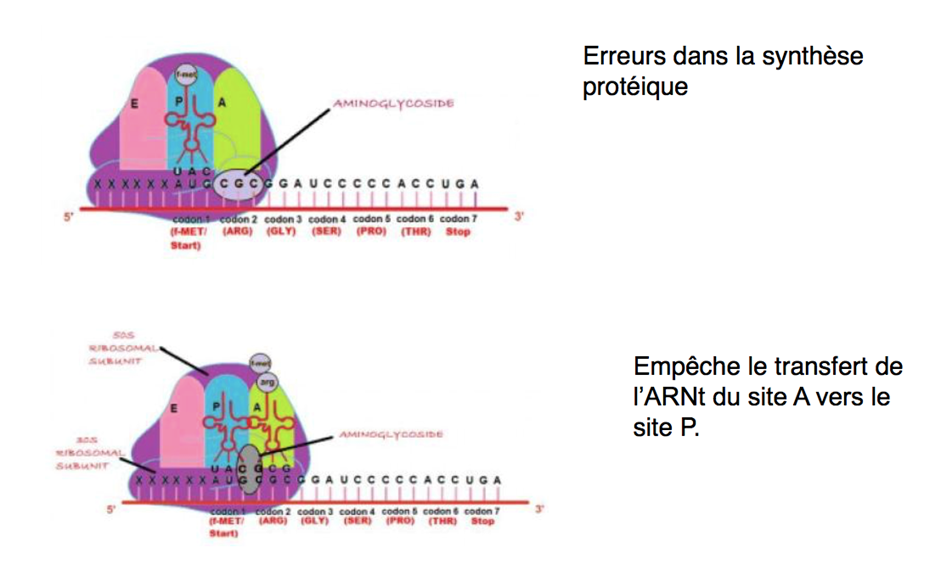
L’apparition de ces médicaments s’est faite dans le but de soigner les patients avec la volonté de traiter les causes mutationnelles de la maladie plutôt que les symptômes de cette dernière. Ces antibiotiques permettent ainsi d’agir à l’échelle moléculaire, en favorisant l’entrée de l’ARNt au niveau des mutations non-sens.
Pour le moment, les antibiotiques utilisant la stratégie de translecture ne sont efficaces que sur certaines mutations, en fonction de leur séquence nucléotidique.
Les antibiotiques testés étant déjà utilisés en milieu hospitalier, cela est très encourageant pour la recherche de traitement de la mucoviscidose PTC. Cependant, ils présentent encore des effets secondaires importants, il est donc préférable pour le futur de s’intéresser à des molécules similaires afin de garder le même mode d’action mais sans les effets indésirables observés.
Les antibiotiques agissant par translecture permettent une lecture imparfaite du codon stop rendant les facteurs de terminaison moins efficaces et permettant la poursuite de la traduction afin d’obtenir une protéine fonctionnelle.
Les antibiotiques les mieux décrits pour induire des erreurs lors de la terminaison de la traduction sont la gentamicine, le G418 et la paromomycine. Il a été récemment découvert un effet similaire avec deux autres antibiotiques : la tobramycine et l’amikacine. D’autres antibiotiques de la famille des aminoglycosides n’ont aucun effet mesurable sur l’efficacité de terminaison de la traduction (Kanamycine, HygromycineB). Les raisons pour lesquelles certains antibiotiques sont efficaces et d’autres non, demeurent encore incertaines, d’autant que les différences structurales sont parfois assez faibles. C’est pour cela que les recherches sont toujours en cours malgré des résultats positifs car on ne trouve pas encore les raisons des différences d’efficacité entre les patients. Il a été démontré indépendamment par deux équipes Américaines que l’efficacité de suppression de ces antibiotiques était fortement dépendante du codon stop et de son contexte nucléotidique.
Il est donc important de retenir que lorsqu’une cellule est traitée par un de ces antibiotiques, tous les codons STOP ne vont pas être supprimés avec la même efficacité. Ceci permet à la cellule de continuer d’exprimer la plupart des ses gènes de manière tout à fait normale.
Le champignon Lepista inversa
Pour affiner nos recherches, sur les thérapies en cours ayant pour but de lutter contre le codon STOP prématuré dans le gène CFTR (qui entraîne la mucoviscidose), nous avons contacté Fabrice Lejeune. Il est directeur de recherche au sein du laboratoire CANcer Heterogeneity, Plasticity and Resistance to THERapies (Inserm/ CNRS/ Université de Lille/Institut Pasteur de Lille/CHU de Lille et ancien élève de la faculté d’Orsay, spécialisé dans le mécanisme de contrôle qualité du NMD (Nonsense-Mediated mRNA Decay) et de l’épissage alternatif. En 2005, il a commencé à étudier ce qui est maintenant sa thématique de recherche : les molécules capables de corriger les mutations non-sens.
Aujourd’hui, beaucoup de laboratoires éparpillés dans le monde s’intéressent aux maladies causées par les mutations non-sens et effectuent de nombreuses recherches. La première découverte a été les antibiotiques, comme nous l’avons vu plus haut, mais les recherches ne se sont pas arrêtées là. Dans le laboratoire de Fabrice Lejeune des résultats sont également paru prometteurs…
En effet, les recherches de F. Lejeune ont commencé par une prospection de molécules à partir d’une extractothèque de 20 000 extraits (extraits de plantes, de champignons et de micro-organismes marins). Les chercheurs ont criblé un extrait appartenant au champignon Lepista inversa pour sélectionner des molécules capables d’induire la translecture des PTC. Parmi cet extrait, deux molécules ont été retenues, la clitocine, déjà connue, et la 2,6-diaminopurine (DAP) qui n’était pas encore connue pour avoir une activité correctrice.
Lepista inversa (ou clitocybe inversé) est un champignon basidiomycètes comestible de la famille des Tricholomataceae qui pousse en France, en Amérique du Nord et en Afrique du Nord.
Pourquoi ce champignon possède cette activité correctrice de mutations non-sens ? ce qu’on sait, c’est que ce champignon n’a pas beaucoup de parasites, on pourrait imaginer que c’est un système de défense pour ce champignon, et que du fait de cette activité, il va entraîner chez celui qui va venir l’agresser, un problème au niveau de la traduction, ce qui pourra entraîner des productions de protéines aberrantes chez ce dernier.
Ces molécules ont été analysées et les recherches sur la clitocine ont été abandonnées car elle a été caractérisée comme toxique. Cependant, la DAP n’a pas été caractérisée comme toxique, les recherches ont donc été poursuivies à partir de 2014-2015. La DAP est donc une molécule qui serait capable d’agir contre les mutations à codon STOP, mais seulement pour les mutations UGA.
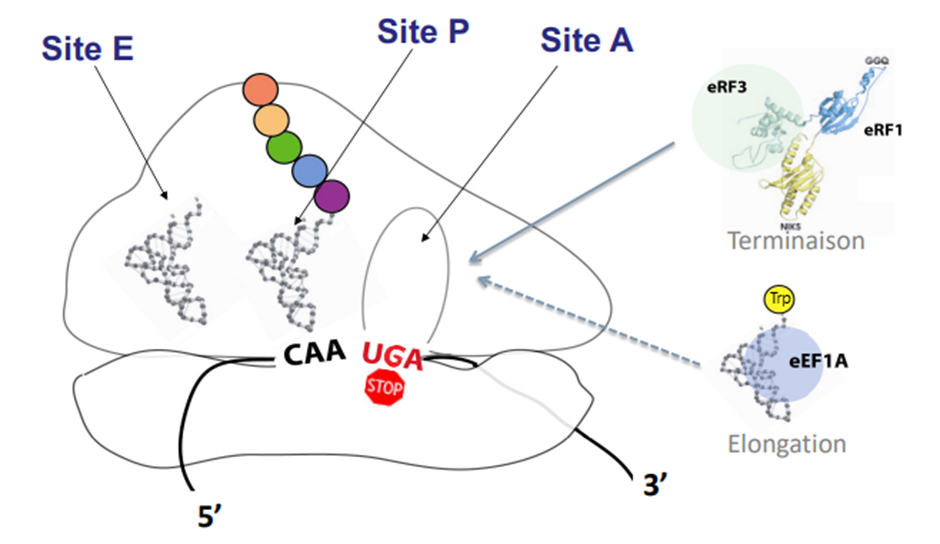
Mais comment fonctionne la DAP ? Au niveau de la traduction, la reconnaissance des codons de terminaison prématuré est étroitement liée au mécanisme de terminaison. Chez les organismes eucaryotes, lorsque le ribosome atteint un codon stop, une compétition se produit au niveau du site A du ribosome entre les ARN de transferts proches cognat et les facteurs de libération eRF1 et eRF3 (cf. schéma de terminaison).
La DAP arrive à reconnaître le codon stop prématuré car il y a une différence d’environnement moléculaires et structurales entre une terminaison prématurée et une terminaison physiologique. Elle inhibe l’enzyme FTSJ1 chez l’homme et TRM7 chez la levure. Cette enzyme modifie post-transcriptionnellement certains ARNt ce qui leur confère leur structure et leur fonction normale et leur permet d’assurer la fidélité de reconnaissance des codons par l’ARNt et son anticodon. Ainsi, en inhibant FTSJ1, les ARNt portant le tryptophane (Trp) et reconnaissant les codons UGG ont acquis la capacité de reconnaître les codons UGA STOP en plus des codons UGG. La différence entre ces deux codons est la troisième base. La reconnaissance du codon stop UGA par l’ARNt Trp est réalisée par hybridation des deux premières bases uniquement (c’est l’effet wobble).
C’est donc sur cette molécule que travaille le laboratoire de Fabrice Lejeune depuis plusieurs années. Beaucoup de tests ont déjà été effectués mais il reste encore les étapes préclinique et clinique à réaliser. Pour l’instant, ils ont testé cette molécule sur des cellules immortalisées en culture, mais aussi directement sur les cellules en culture de patients, avec l’aide de l’association “Vaincre la mucoviscidose” et les résultats ont montré que ça a fonctionné. Ils ont également fait des tests sur des organoïdes dérivés de patient atteint de mucoviscidose (les organoïdes sont des cellules qui s’assemblent pour mimer les fonctions d’un organe) et ils ont montré qu’il était possible de restaurer les fonctions du canal CFTR. Enfin d’autres tests ont été réalisés sur la souris, porteuse de mutation non-sens dans le gène CFTR. Aujourd’hui il leur reste encore deux grosses étape à réaliser avant de pouvoir tester directement sur un patient malade: mettre la DAP sous une forme qui puisse être administrée chez un patient (formulation), faire des tests de toxicité supplémentaire (des tests standardisés fait par des entreprises spécialisées) qui permettent d’avoir des résultats normalisés, on pourra donc bien comparer les effets de cette molécule par rapport à d’autres, ce qui leur permettra de voir si cette molécule peut bien être administrée à un patient. Donc pour faire des essais cliniques, sur l’homme directement, il faudra auparavant réaliser ces deux étapes.
source : 2,6-Diaminopurine as a highly potent corrector of UGA nonsense mutations,
Nat Commun 2020 Mar 20;11(1):1509
Les autres
En parallèle, d’autres laboratoires ont également trouvé des molécules qui pourraient réussir à agir contre les mutations non sens.
Dans un premier temps, la société pharmaceutique américaine PTC Therapeutics à découvert une molécule. Cette molécule a été identifiée dans un crible de 800 000 molécules, on l’appelle l’ataluren (ou PTC124). Pour le moment les essais cliniques de celle-ci ont été fait sur deux pathologies: la maladie de Duchenne, et la mucoviscidose. Mais les résultats étaient assez modestes, l’efficacité de la molécule n’a pas été « reconnue » ce qui n’a pas permis la mise sur le marché. Ils continuent néanmoins à faire des essais sur d’autres pathologies.
Une autre entreprise, du nom de Elox Pharmaceuticals, effectue également des recherches contre les mutations non-sens. La molécule, du nom de ELOX02, n’a pas été identifiée par criblage, c’est un molécule dérivée d’une famille d’antibiotique, qui possède la capacité de corriger les mutations non sens. La famille des aminoglycosides. Le problème des aminoglycosides, c’est qu’ils ont une toxicité qui ne leur permet pas d’être administré aux patients sur un très long terme, ce qui serait le cas si on veut traiter des patients atteint de maladies génétique, puisque ça sera pour toute la vie du patient. L’idée d’ELOX Pharmaceuticals, est de travailler sur ces molécules pour les rendre moins toxiques. C’est sur quoi ils sont en train de travailler avec ELOXO2, pour que la molécule soit moins toxique et plus efficace.
En outre, depuis déjà 30 ans, les chercheurs tentent de développer différentes méthodes de thérapie génique pour lutter contre les mutations non-sens. Ils trouvent des manières de plus en plus efficaces qui ont déjà mené à des résultats prometteurs dans le cadre de certaines études cliniques.
En Mars 2022, un article sur la thérapie génique est paru dans Nature. Ce que nous pouvons en retenir c’est que les recherches sont promettrices puisqu’on peut cibler spécifiquement chacun des codons stop et faire varier l’acide aminé incorporé, ce qui peut aider à garder la structure et la fonction de la protéine. Néanmoins, comme pour la translecture avec des drogues, ce n’est pas n’importe quel acide aminé qui est incorporé mais un proche cognat (c’est à dire dont l’anticodon est partiellement complémentaire du codon STOP), donc parfois l’acide aminé incorporé n’est pas toujours compatible avec la structure et la fonction.
Nom de l’article : AAV-delivered suppressor tRNA overcomes a nonsense mutation in mice, Nature volume 604, pages 343–348 (2022)
Conclusion
De nombreux laboratoires dans le monde s’intéresse aux mutations non-sens, c’est pour cela qu’aujourd’hui de nombreuses recherches sont en cours sur des molécules différentes, que ce soit des recherches sur l’ataluren, sur ELOX 02, la DAP, sur les aminoglycosides, ou bien d’autres encore. A l’heure actuelle, il n’y a pas de traitements disponibles pour les patients atteints de mucoviscidose au niveau des mutations à codon stop, néanmoins, des traitements au niveau des infections pulmonaires de ceux-ci sont disponible, afin d’améliorer leur qualité de vie, mais ça ne les soigne pas.
Une dizaine de laboratoires ont déjà publié des molécules, qui corrigent les mutations ou qui aident d’autres molécules à corriger les mutations non sens. C’est une approche thérapeutique très prometteuse, qui attire d’autres chercheurs à venir sur ce domaine de recherches. Il y a une bonne dynamique autour de ce domaine, les chercheurs espèrent alors qu’au moins une de ces molécules arrivera à être donnée aux patients.